Урок открытия новых знаний по химии
у 9 классов на тему: «Соединения щелочных металлов»
(УМК: Химия. О.С.Габриелян)
Этапы
урока
| Деятельность учителя | Деятельность учащихся | Планируемые результаты | |
| 1. Организационный момент. | Приветствует учащихся, проверяет готовность к уроку | Приветствуют учителя, осуществляют самопроверку готовности к уроку | Личностные УУД: формирование навыков самоорганизации, эмоциональный настрой на урок |
| 2. Актуализация опорных знаний и умений (повторение пройденного) | Каждая пара учащихся выполняет тестовое задание по пройденной теме «Щелочные металлы» (Приложение 1). На тест отводится 8 минут. По окончании проводят взаимоконтроль | Учащиеся выполняют тестовое задание в парах, осуществляют взаимоконтроль | Познавательные УУД: активизация имевшихся ранее знаний; Коммуникативные УУД: формирование умения оценивать работу товарищей |
| 3. Мотивация к изучению нового материала. | 1. А можно ли встреть щелочные металлы в свободном виде в природе? Почему? 2. Предположите, в виде каких соединений они могут находиться в природе? В природе щелочные металлы встречаются только в виде соединений. Na и К в природе встречаются в виде хлоридов, сульфатов, силикатов и т.д. Li, Rb, Cs входят в состав различных минералов. Fr встречается в радиоактивных рудах. 3. На столе находятся объекты, содержащие соединения щелочных металлов (сода, соль, пальчиковые батарейки, мыло). Посмотрите на эти объекты. Как вы думаете, что их объединяет? 4. О чем мы еще не успели поговорить? Это и будет темой нашего урока. Тема урока «Соединения Щ.М.» | Учащиеся делают заключение, что речь пойдет о соединениях Щ.М., их свойствах, применении соединений Щ.М. Называют тему урока, составляют план её изучения. Учащиеся делают заключение, что речь пойдет о соединениях Щ.М., их свойствах, применении соединений Щ.М. Называют тему урока, составляют план её изучения. | Регулятивные УУД: умение ставить учебную задачу, планировать этапы ее решения. Познавательные УУД: развитие и углубление потребностей и мотивов учебно-познавательной деятельности; Личностные УУД: формирование мотивации к обучению и целенаправленной познавательной деятельности. Коммуникативные УУД: формирование умения строить речевое высказывание в соответствии с поставленными задачами. |
| 4. Усвоение новых знаний | Учитель делит учащихся на 3 группы. Каждой группе выдается задание, которое необходимо выполнить за 10 минут и представить отчет перед классом. (Приложение 2) 1 группа выполняет задания по изучению химических свойств оксидов Щ.М на примере оксида калия 1. Написать уравнение реакции оксида натрия с водой. Na2O + H2O = 2NaOH Ребята на доске и в тетради записывают уравнения химической реакции. 2. Написать уравнение реакции оксида натрия с серной кислотой Na2O + H2SO4 = Na2SO4 + H2O Ребята на доске и в тетради записывают уравнения химической реакции. 3. Написать уравнение реакции оксида натрия с оксидом углерода (IV) Na2O + CO2 = Na2CO3 Сделайте вывод о химических свойствах оксидов щелочных металлов. ВЫВОД: оксиды ЩМ способны реагировать с кислотами, кислотными оксидами, водой | Учащиеся экспериментально доказывают химические свойства соединений Щ.М. Делают выводы на основе опытных данных | Познавательные УУД: формирование знаний о свойствах и применении соединений щелочных металлов; совершенствование экспериментальных умений и навыков учащихся. Регулятивные УУД: умение решать учебную задачу согласно инструкции; развитие умений выбирать и анализировать информацию, полученную в результате эксперимента, работы с учебником Коммуникативные УУД: формировать умение планировать работу в группе, логически излагать свои выводы. Личностные УУД: развивать познавательный интерес школьников, используя данные о применении изучаемых явлений в окружающей жизни. |
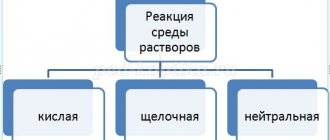
| 2 группа выполняет задание по изучению химических свойств гидроксида натрия. Цель: экспериментально доказать химические свойства соединений щелочных металлов на примере гидроксида натрия. Инструкция 1.Налейте в чистую пробирку гидроксид натрия, добавьте несколько капель фенолфталеина. Что наблюдаете? На какую среду раствора указывает цвет в пробирке? (щелочную) 2.Добавьте в эту же пробирку раствор соляной кислоты. Что наблюдаете?(окраска исчезла, реакция нейтрализации). Запишите уравнение реакции.NaOH + HCl→ NaCl + H2O Ребята на доске и в тетради записывают уравнения химической реакции в ионном виде. 3.Налейте в чистую пробирку гидроксид натрия и добавьте раствор сульфата меди. Что наблюдаете? Запишите уравнение реакции. 2NaOH +CuSO4→ Na2SO4 + Cu(OH)2 ↓ Ребята на доске и в тетради записывают уравнения химической реакции в ионном виде. 4.Получите гидроксид цинка: к хлориду цинка добавьте по каплям (осторожно) гидроксид натрия. Что наблюдаете? Запишите уравнение реакции. 7.ZnCl2 + 2NaOH→ 2NaCl + Zn(OH)2 ↓ Ребята на доске и в тетради записывают уравнения химической реакции в ионном виде. | |||
| 5.В пробирку с гидроксидом цинка осторожно (по каплям) добавьте гидроксид натрия (до полного растворения осадка). Что наблюдаете? Запишите уравнение реакции. 2NaOH +Zn(OH)2→ Na2ZnO2 + H2O Ребята на доске и в тетради записывают уравнения 6.Напишите уравнение реакции взаимодействия гидроксида натрия с углекислым газом 2NaOH + CO2 = Na2CO3 + H2O Сделайте вывод о химических свойствах гидроксидов щелочных металлов. ВЫВОД: гидроксиды ЩМ способны реагировать с кислотами, кислотными оксидами, солями, амфотерными гидроксидами. 3 группа заполняет таблицу, пользуясь учебником стр. 91 выписать применение солей Щ.М. Формула соли | Название | Применение | |
| NaHCO3 | |||
| K2CO3 | |||
| NaCl | |||
| Na2SO4 ∙ 10 H2O | |||
| Na2CO3 ∙ 10 H2O |
4 группа готовит сообщения, пользуясь учебником стр. 91, о значении ионов натрия и калия для живых организмов.
Na→Na2O2 →Na2O→X→Na2SO4
↓ ↓
NaOH NaCl
применение полученных знаний при практическом решении задач
Личностные УУД:
формирование познавательных интересов и мотивов, направленных на изучение программы
1. Что нового вы узнали сегодня на уроке?
2. Какие затруднения у вас возникли при работе?
3. Помогло ли вам выполнение лабораторной работы при изучении нового материала?
4. Остались ли вопросы по новой теме
учатся адекватно анализировать свою деятельность и деятельность товарищей
§ 14 упр. 1
Приложение 1
1. К щелочным металлам не относится: а) рубидий; в) калий; б) цезий; г) медь.
2. Электронная формула 1s2 2s2 2p6 3s2 3p6 4s1 соответствует элементу: а) литию; в) калию; б) натрию; г) меди.
3. Радиус атома у элементов I группы главной подгруппы с увеличением заряда ядра (в группе ↓):
а) изменяется периодически; в) не изменяется;
б) увеличивается; г) уменьшается.
4. Щелочные металлы проявляют очень сильные: а) окислительные свойства; в) восстановительные свойства; б) амфотерные свойства; г) нейтральные свойства.
5. Во всех своих соединениях щелочные металлы проявляют степень окисления: а) +1; в) +2; б) +3; г) +4.
6. К физическим свойствам щелочных металлов не относится: а) серебристо-белые; в) хорошие электропроводники; б) мягкие и легкие; г) тугоплавкие.
7. При взаимодействии элементов I группы главной подгруппы с водой образуется:
а) кислота; в) оксид и выделяется водород; б) щелочь и выделяется водород; г) соль.
8. При взаимодействии кислорода со щелочными металлами пероксид образуется только с:
а) литием; в) цезием б) натрием; г) рубидием.
9. Натрий и калий хранят в керосине, потому что они: а) имеют резкий запах; в) легко окисляются на воздухе; б) очень легкие; г) сильные окислители
Приложение 2
1 группа выполняет задания по изучению химических свойств оксидов щелочных металлов на примере оксида калия.
Цель: выяснить химические свойства оксида калия.
Инструкция
1. Написать уравнение реакции оксида натрия с водой.
2. Написать уравнение реакции оксида натрия с серной кислотой
3. Написать уравнение реакции оксида натрия с оксидом углерода (IV) — углекислый газ
Сказать о цели работы и сделать вывод о химических свойствах оксидов щелочных металлов.
ВЫВОД: оксиды ЩМ способны реагировать с ____________________________________
2 группа выполняет задание по изучению химических свойств гидроксидов щелочных металлов на примере гидроксида натрия.
Цель: экспериментально доказать химические свойства гидроксида натрия.
Инструкция
1. Налейте в чистую пробирку гидроксид натрия, добавьте несколько капель фенолфталеина. Что наблюдаете? На какую среду раствора указывает цвет в пробирке?
2. Добавьте в эту же пробирку раствор соляной кислоты. Что наблюдаете? Запишите уравнение реакции. 3.Налейте в чистую пробирку гидроксид натрия и добавьте раствор сульфата меди. Что наблюдаете? Запишите уравнение реакции.
4. Получите гидроксид цинка: к хлориду цинка добавьте по каплям (осторожно) гидроксид натрия. Что наблюдаете? Запишите уравнение реакции.
5. В пробирку с гидроксидом цинка (амфотерный) осторожно (по каплям) добавьте гидроксид натрия (до полного растворения осадка). Что наблюдаете? Запишите уравнение реакции. 6. Напишите уравнение реакции взаимодействия гидроксида натрия с углекислым газом
Сказать о цели работы и сделать вывод о химических свойствах гидроксидов щелочных металлов.
ВЫВОД: гидроксиды ЩМ способны реагировать с : _______________________________
3 группа (5 человек) заполняет таблицу, пользуясь учебником стр. 90 – 91 выписать применение солей щелочных металлов.
| Формула соли | Название | Применение |
| NaHCO3 | ||
| K2CO3 | ||
| NaCl | ||
| Na2SO4 ∙ 10 H2O | ||
| Na2CO3 ∙ 10 H2O |
4 группа готовит сообщения, пользуясь учебником стр. 91, о значении ионов натрия и калия для живых организмов (растений и животных). Продукты, содержащие данные ионы.
КАЛИЙ
Калий необходим абсолютно всем растениям, животным и микроорганизмам на Земле. Основная масса калия находится в цитоплазме и вакуолях клеток. Установлено, что в пластидах и ядрах клеток калий отсутствует. Почти 80 % калия находится в клеточном соке и легко вымывается водой, особенно из старых листьев, повышает устойчивость растений к увяданию и преждевременному обезвоживанию и тем самым увеличивает сопротивляемость растений кратковременным засухам. Калий влияет на образование клеточных оболочек, повышает прочность стеблей злаков и их устойчивость к полеганию. От калия заметно зависит качество урожая. Недостаток его приводит к щуплости семян, понижению их всхожести и жизненности; растения легко поражаются грибными и бактериальными заболеваниями. Калий улучшает форму и вкусовые качества картофеля, повышает содержание сахара в сахарной свекле, влияет не только на окраску и аромат земляники, яблок, персиков, винограда, но и на сочность апельсинов, улучшает качество зерна, листа табака, овощных культур, волокна хлопчатника, льна, конопли. Наибольшее количество калия требуется растениям в период их интенсивного роста.
В животном организме калий находится преимущественно в жидкостях тела и мягких тканях, где является необходимым элементом для поддержания осмотического давления, регуляции реакции крови и тканевой жидкости. Этот минерал регулирует водный баланс и сердечный ритм, наряду с натрием и хлором, принимает участие в энергетическом балансе, способствует выделению солей натрия. Кроме того, калий в организме человека благоприятно воздействует на работу головного мозга, способствуя улучшению процессов снабжения его кислородом. Оптимальная концентрация калия повышает выносливость организма. Нарушение баланса этого элемента, прежде всего, негативно сказывается на функционировании мышц и работе нервной системы.
Наибольшее количество данного минерала можно встретить в меде и яблочном уксусе. Затем следуют такие продукты, как: изюм, все виды свежих ягод и зелени, пшеничные отруби, сухофрукты и орехи. Картофель, капуста брюссельская, томаты, морковь, свекла, лук, чеснок и красный перец – растительная пища, которая растет практически в каждом огороде, тоже оказалась богатой на калий. Не отстают и грибы.
Ещё одним кладезем калия являются фрукты: бананы, яблоки, персики, абрикосы, виноград, хурма, апельсины, грейпфрут и мандарины — содержание в этих продуктах колеблется от 400 до 200 мг калия на 100 грамм пищи.
НАТРИЙ
Натрий имеет огромное значение в организме человека. Он активно участвует в функционировании процессов обмена внутри клеток и между ними. Именно этот микроэлемент является главным катионом (то есть ионом, заряженным положительно) внеклеточной жидкости, а значит, нормализует осмотическое давление. Помимо этого натрий отвечает за регуляцию движения воды и возбудимость нервно-мышечных волокон, за нормализацию кислотно-основного состояния. При взаимодействии натрия, калия и хлора создается электролитическая среда, обеспечивающая нервным окончаниям правильное функционирование, что способствует сокращению мышц. Данный микроэлемент обладает способностью удерживать в организме воду, что особенно необходимо для предотвращения обезвоживания. Оптимальное количество натрия ведет к нормализации артериального давления, тогда как его избыток чреват гипертонией.
Натрий участвует в транспортировке полезных веществ через клеточные мембраны, являясь одним из компонентов т.н. натрий-калиевого насоса. Кроме того, он регулирует доставку углеводов в растениях. Отмечено, что при хорошей обеспеченности культур натрием повышается их зимостойкость. Недостаток элемента способствует ухудшению образования хлорофилла.
Натрий в различной концентрации присутствует практически во всех продуктах питания. Однако основными источниками этого макроэлемента являются обычная соль и минеральная вода. Так, например, дневную потребность в натрии можно удовлетворить, употребив вместе с пищей чайную ложку поваренной соли. Наряду с этим, достаточно большое количество Na содержат следующие пищевые продукты: дары моря (морская рыба, водоросли, омары, крабовое мясо, мидии, креветки); бобовые культуры; куриные яйца; молоко.
Щелочные металлы (конспект урока)
Структура
ЭЙ
АР ГАЙД
| до | утверждения | после |
| Щелочные металлы хранятся под слоем керосина | ||
| Щелочные металлы активно взаимодействуют с водой | ||
| Самый активный металл литий | ||
| Щелочные металлы в соединениях проявляют степень окисления +1 | ||
| В природе щелочные металлы встречаются в виде соединений |
Давайте посмотрим видеофрагмент о щелочных металлах.
После просмотра прочтите все утверждения. В столбике ПОСЛЕ
поставьте +, если вы согласны с утверждением или — , если вы не согласны с утверждением. Сравните столбики
ДО
и
ПОСЛЕ
. Изменились ли ваши убеждения после просмотра видеофрагмента?
Характеристика щелочных металлов по положению в ПС:
Структура РАУНД ТЭЙБЛ
Щелочные металлы — элементы …… группы, …………… подгруппы.
Радиус атомов ЩМ с возрастанием заряда ядер …………………………
Восстановительные свойства ЩМ с возрастанием заряда ядер ……………………….
Степень окисления щелочных металлов в соединениях равна ……………………….
Предполагаемые ответы учащихся
Щелочные металлы — элементы 1 группы, главной подгруппы.
Радиус атомов ЩМ с возрастанием заряда ядер возрастает.
Восстановительные свойства ЩМ с возрастанием заряда ядер увеличиваются
Степень окисления щелочных металлов в соединениях равна +1
Физические свойства ЩМ
Структура: 800 РУБЛЕЙ САМЭРИ
Учащиеся записывают физические свойства ЩМ, стоимость 1 слова – 80 рублей.
Предполагаемые ответы учащихсяЩелочные металлы серебристо-белые, мягкие, легкоплавкие, легкие, режутся ножом, с характерным блеском.
Химические
свойства ЩМ
Зная общие физические свойства, активность металлов, предположите химические свойства щелочных металлов. Проговорите, какие вещества взаимодействуют друг с другом?
Структура ТАЙМД-ПЭА-ШЭА
Предполагаемые ответы учащихся
Щелочные металлы взаимодействуют как с простыми веществами, и сложными. Активно взаимодействуют почти со всеми неметаллами. Из сложных веществ с водой – образуя растворимые в воде основания – щелочи. Они легко отдают электроны, поэтому являются очень сильными восстановителями. Во всех соединениях проявляют степень окисления +1.
А теперь на опытах убедимся, в правильности наших предположениях о химических свойствах щелочных металлов.
Мыслительный прием
ФИНКИН ЭЛАУД
Просмотрите видеофрагмент «Взаимодействие щелочных металлов с водой». Проговорите какие вещества взаимодействуют друг с другом, что получилось в результате реакции. Запишите уравнение реакции.
Информация для любознательных:
Недостаток
литияспособствует развитию у человека маниакально-депрессивных синдромов психических заболеваний. Приступы способен прекращать карбонат лития. Избыток проявляется в дрожании пальцев, нарушениях равновесия, сонливости, жажде, нарушении сердечного ритма. Литий содержится в свекле.