План урока:
Словно компоненты конструктора, атомы соединяются между собой. И как бы, Вы не старались, но с единичным блоком можно соединить, только один блок. Деталь на 4 ячейки, может удержать не больше четырёх. Этот принцип сохраняется и в химии. За количество свободных ячеек отвечает валентность атомов элементов.
Результатом взаимодействия атомов является получение веществ. Виды химической связи атомов зависят от природы составляющих элементов.
Металлы отличаются малым количеством электронов на внешнем уровне сравнительно с неметаллами более низким значением электроотрицательности. Теперь наша задача вспомнить, как происходит изменение ЭО в таблице Менделеева или воспользоваться таблицей «Относительная электроотрицательность». Чем активнее неметалл, тем она выше и это говорит о том, что этот элемент, при образовании связи, будет забирать электроны.
Веществ насчитывается миллионы. Это могут быть простые вещества: металлы железо Fe, золото Au, ртуть Hg; неметаллы сера S, фосфор Р, азот N2. Так и сложные вещества: H2S, Ca3(PO4)2, (C6H10O5)n, молекулы белков и т.д.Комбинация элементов, входящих в состав веществ, определяет какие типы связей будут существовать между ними.
Ковалентная связь
Неметаллы из числа всех элементов находятся в меньшинстве. Но имея некоторые особенности в строении и способности иметь переменную валентность, число соединений, построенных этими элементами внушительное.
Чтобы иметь представление, по которому атомы соединяются, начнём с молекулы водорода Н2.
Давайте дадим волю фантазии, представим то, что нельзя увидеть. Допустим, что мы взяли в руки две одинаковые детали, имеющие такой вид:
Существует одна только комбинация их соединения, и между ними будет одно общее звено. Переместимся с нашего воображения к молекулам. Представим, что перед нами, два атома водорода и наша задача их соединить в молекулу. Покрутите мысленно детали, чтобы они объединились, необходимо их поставить друг на друга, связав их в определённом месте. Точки рядом означают, сколько электронов, располагающихся на наружном слое.
Источник
Атомы водорода, как детали, соединились одной связью, поэтому валентность в данном случае каждого из них будет равна I. Но степень окисления будет равна 0, так как вещество образовано элементом с одинаковым значением электроотрицательности.
Рассмотрим, как образуется молекула самого распространённого газа на нашей планете – азота N2.
Азот, имеет 3 неспаренных электрона. Это как взять две детали вида и соединить их.
Таким образом, азот трёхвалентен, а степень
окисления по-прежнему остаётся равна 0. За счёт общей электронной пары азот завершает внешний слой 2s22p6.
Ковалентная связь в молекуле, состоящей из одного типа атомов, а именно неметаллов, носит название неполярная.
Во время построения молекулы, количество электронов стремится к завершению. Рассмотрим как образуется молекула О2. Каждому атому не хватает 2 электронов и они эту недостачу компенсируют общей электронной парой.
Также обращаем внимание, что степень окисления 0, ибо атомы равноправные партнёры, и их валентность равна II.
Ковалентная химическая связь образованная разными неметаллами называется полярная.
Возьмём два неметаллических элемента Водород и Хлор. Укажем электронные формулы внешнего слоя.
Н 1s1
Cl 3s2 3p5
Проанализировав значения, Э(Н) < Э(Cl), приходим к выводу, чтобы принять конфигурацию благородного газа, хлор будет притягивать на себя единственный электрон водорода.
Схема ковалентной связи, образованной разными элементами, записывается в таком виде.
Столь важно отметить, что в этой ситуации Cl и Н не будут равноправными партнёрами, поскольку общая плотность электронов сосредоточена у Cl. Водород в неравном бою, уступает 1 электрон хлору, у которого в наличии их целых 7. Водород приобретает положительный заряд, хлор – отрицательный. Валентности Н и Cl равны I.В то время степени окисления будут Н+Cl−.
Такой вид образования соединений происходит по обменному механизму. Это значит, чтобы получить завершённую конфигурацию более электроотрицательные принимают электроны, менее – отдают, но при этом существует общая электронная пара.
Неметаллы образуют не только бинарные соединения, а возможно в состав будет входить три и более элемента. К примеру, молекула угольной кислоты H2СO3 состоит с 3 элементов. Как они между собой соединяться. Электроотрицательность возрастает в ряду ЭО (Н) <�ЭО (С) <�ЭО(O). Определим степени окисления каждого элемента. Н+2С+4О−23. Это означает, что кислород будет притягивать на себя электроны углерода и водорода. Схематически это можно записать в следующем виде.
Чтобы построить структурную формулу, в центре записываем углерод. У него неспаренных 4 электрона. Поскольку атомов кислорода в количестве 3, каждый из них может принять 2 электрона. То путём не хитрых вычислений, видим что 4 электрона придёт от С и по одному от каждого Н. проверяем наш расчёт, учитывая нейтральность молекулы, считаем положительные и отрицательные заряды.
Н2+С+4О3−2 (+1 ∙ 2) + (+4 ∙ 1) + (-2 ∙ 3) = 0
Существует ещё один механизм ковалентной связи, под названием донорно-акцепторный.
Чтобы понять этот принцип, опишем образование молекулы, имеющей не совсем приятный резкий, удушающий запах, аммиак NH3.
H 1s1
N 2s2 2p3
Из 5 электронов, находящиеся в распоряжении атома N, связываются только 3. Валентность атома N приобретает значение III. При этом степень окисления N−3 (оттянув на себя 3 электрона от каждого атома Н, становится отрицательным), водород, наоборот совершив «благородный поступок», отдав электрон, приобретает положительный заряд Н+. Два электрона никак не задействованы, они выделены красным цветом. Они способны поселиться в свободной ячейке иона Н+. Это место займут электроны азота, которые обозначены красным цветом. Образуется катион аммония по донорно-акцепторному механизму.
Незадействованные до этого «красные» электроны N «заселяются» в пустой s-орбитали, принадлежащей катиону водорода. Ион аммония имеет 3 связи, которые происходят по обменному механизму, а также одну, по донорно-акцепторному. Именно поэтому NH3 легко взаимодействует с кислотами и водой.
§ 6. Водородная химическая связь
Рассмотрением водородной связи мы завершаем наше знакомство с типами химической связи. И это не случайно.
Во-первых
, водородная связь — это частный случай межмолекулярного взаимодействия. Энергия такой связи примерно в 10 раз меньше, чем ковалентных и ионных химических связей, и составляет всего лишь 4—40 кДж/моль, т. е. вписывается в энергетическую характеристику межмолекулярных сил.
Во-вторых
, рассмотрение водородной связи позволит сравнить эту химическую связь с другими типами и тем самым обобщить наши представления о природе химической связи вообще.
В-третьих
, это самая значимая на нашей планете химическая связь, ибо она определяет структуру соединений, которые являются носителями жизни на Земле (белки и нуклеиновые кислоты), отвечают за хранение и воспроизведение наследственной информации живых организмов.
Все рассмотренные ранее типы химической связи (вспомните какие
) имеют названия, в основу которых положены следующие химические понятия: «ионы», «атомы», «металлы». А водородная связь — специфический термин, связанный с конкретным химическим элементом — водородом. Очевидно, это связано с особенностью строения атома водорода, имеющего один- единственный валентный электрон. Участвуя в образовании химической связи, этот электрон обнажает крохотное ядро атома водорода, представляющее собой не что иное, как обыкновенный протон.
Образованием межмолекулярной водородной связи объясняется тот факт, что даже вещества с небольшими относительными молекулярными массами при обычных условиях представляют собой жидкости (вода; спирты — метанол, этанол, пропанол; карбоновые кислоты — муравьиная, уксусная) или легко сжижаемые газы (аммиак, фтороводород).
Механизм образования водородной связи состоит в электростатическом притяжении атома водорода, имеющего частичный положительный заряд, и атома кислорода (фтора или азота), имеющего частичный отрицательный заряд.
В образование водородной связи вносит свой вклад и донорно-акцепторное взаимодействие между почти свободными орбиталями атомов водорода и неподелён- ными электронными парами атомов кислорода (фтора или азота). Например, вода ассоциирована в жидкость за счёт водородных связей, возникающих между молекулами-диполями.
В жидкой воде образуются водородные связи между множеством молекул. А вот молекулы карбоновых кислот наиболее устойчивы в виде димеров, также образованных водородными связями:
Алхимическое правило растворения «подобного в подобном» объясняется образованием водородной связи между молекулами растворителя и молекулами растворённого вещества.
Так, метиловый и этиловый спирты, этиленгликоль и глицерин, уксусная и муравьиная кислоты неограниченно растворяются в воде, например:
Способность некоторых газов, например аммиака, за счёт образования водородных связей
легко сжижаться (при давлении 0,9 МПа и комнатной температуре) и вновь переходить в газообразное состояние с поглощением теплоты позволяет использовать их в качестве хладагентов в промышленных холодильных установках (рис. 30).
Продолжение >>>
Ионная связь
Ионная химическая связь является пограничной ковалентной полярной. Отличаются тем, что для веществ, в которых локализуется ковалентная связь, характерно существование совместной электронной пары, тогда как для ионной связи свойственна полная отдача электронов. Следствием отдачи является образование заряженных частиц – ионов.
Определить тип связи помогут вычисления. Если разность значений электроотрицательностей больше 1,7, то для вещества характерна ионная связь. Если значение меньше 1,7, то свойственная полярная связь. Рассмотрим два вещества NaCl и СаС2. Оба они образованы металлом (Na и Са) и неметаллом (Clи С). Однако в одном случае связь будет ионная, во втором – ковалентная полярная.
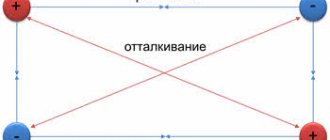
Постулат физики гласит, что противоположности притягиваются. Т.е. положительные ионы притягивают отрицательные и наоборот.
Допустим, что необходимо получить вещество с атомов калия и фтора. Каждый атом стремится заполучить конфигурацию благородного газа. Достигнуть этого возможно двумя способами отдав или приняв электроны, образуя при этом ионы с желаемой конфигурацией.
Атому калия гораздо проще отдать 1 электрон, чем забрать у фтора 7. Принимая 1 электрон, F имеет завершённый уровень.
Аналогично калий, который с лёгкостью отдал свой электрон, его катион принял электронную формулу аргона.
Кальций двухвалентный металл, то для взаимодействия необходимо два атома фтора, поскольку он способен принять только один электрон. Схема образования ионной связи имеет вид.
Данный вид связи локализуется во всех солях, между металлом и кислотным остатком. В выше приведённом примере для угольной кислоты, кислотным остатком будет СО32−, если вместо водорода поставить атомы натрия, то схема образования связи имеет вид.
Следует отметить, что ионная связь будет существовать между Naи О, а между С и О ковалентная полярная.
Металлическая связь
Металлы существуют в разных цветах: чёрные (железо), красные (медь), жёлтые (золото), серые (серебро), плавятся при разных температурах. Однако их всех объединяет наличие блеска, твёрдости, электропроводимости.
Металлическая связь имеет черты сходства с ковалентной неполярной. Металлы бедны электронами на внешнем уровне, поэтому при образовании связи, они не способны притягивать на себя их, для них свойственна отдача. Так как атомный радиус в металлах большой, это даёт возможность легко оторваться электронам, образовав катионы.
Me0 — ne = Men+
Электроны постоянно перемещаются от атома к иону и наоборот. Сами катионы можно сравнить с айсбергами, окружёнными отрицательными частицами.
Схема металлической связи
Конспект урока Металлическая химическая связь
Урок химии в 8 классе по теме «Металлическая химическая связь» (с использованием технологии критического мышления
).
Цели урока:
Образовательные
:
- познакомить учащихся с металлической связью, знать определение металлической связи;
- уметь объяснять свойства металлов, исходя из типа химической связи, находить черты сходства и различия ее с ковалентной и ионной связью;
Развивающие:
- создание условий для развития умения самостоятельно приобретать знания, используя различные источники информации;
- развитие критического мышления, памяти, внимания, наблюдательности.
Воспитательная:
воспитание положительной мотивации учения, правильной самооценки и чувства ответственности.
Тип урока: —
изучение нового материала.
Оборудование:
ПК, медиапроектор, на доске — формулы веществ на магнитах, на каждом столе у учащихся – мини-лекция, образцы металлов и сплавов, листки чистой бумаги, бланк с заданиями.
Ход урока
1. Стадия вызова —
Добрый день, ребята! Садитесь. Мне приятно видеть вас снова на уроке химии.
— Я уверена, что наша работа будет плодотворной. Вы все сможете достигнуть положительного результата в учебном труде. Вы все успешны. Но для этого надо трудиться. Как сказал Плавт, римский драматург: «Кто хочет съесть ядро ореха, должен расколоть его скорлупу» (слайд 1)
СОСТАВЛЕНИЕ КЛАСТЕРА ( ПУЧОК)
Задачи этой стадии:
- самостоятельное определение учащимися направлений в изучении темы, тех ее аспектов, которые хотелось бы обсудить и осмыслить;
- самостоятельная актуализация по теме и пробуждение познавательной активности;
на этой фазе работы заслушивается коллективное мнение, знание об этом понятии и выявляются остаточные знания. На этом этапе не дается оценка знаний. Но кластер пока с доски не стирается. Учитель ставит перед ребятами вопрос: « А соответствуют ли ваши представления научным понятиям?» и ставит учебную задачу.
Учитель: Что мы изучаем с вами в течение нескольких уроков? Ученики: Химическую связь. Учитель: Что мы знаем о химической связи? Ученики: Типы химических связей, их механизмы образования . Учитель: Какие типы химических связей мы изучили? Ученики: Ионную и ковалентную: неполярную и полярную. Учитель: Какую химическую связь называют ионной? Ковалентной? Какая связь называется ковалентной неполярной и полярной? Ученики дают определение типам связи. Учитель: Ребята, на доске даны формулы веществ распределите их по типам связи. Формулы веществ: NaCl , O2 , HCl , Na , K2S , H2S, Mg , H2 ,Al . У каких веществ вы затруднились определить тип химической связи? Что это за вещества, определите по периодической системе? А если образуется простое вещество металл? Какой вид связи может быть в этих веществах?
(предположение: металлическая)
Верно. И тема урока сегодня: «Металлическая химическая связь» (Слайд 2)(запись в тетрадях)
Химическая связь
↓
Типы химической связи
↙ ↓ ↘
? Ионная Ковалентная
Металлическая ↙ ↘
Неполярная Полярная Учитель: Ребята, у вас на столах лежат образцы металлов и сплавов. Внимательно рассмотрите их. – Вы уже знаете, как взаимодействуют между собой атомы металлов и неметаллов, а также атомы неметаллов между собой. – Сегодня мы рассмотрим, как будут взаимодействовать атомы металлов между собой. Почему металлы существуют в виде слитка, куска или металлического изделия? – Что удерживает атомы металла в единое целое? – Какими свойствами обладают металлы и от чего они зависят – мы с вами должны ответить на этом уроке (Слайд 3) – Целью нашего урока является: (Слайд 4)
- Сформировать понятие о металлической связи.
- Изучить механизм образования связи.
- Познакомиться со свойствами металлов.
2. СТАДИЯ ОСМЫСЛЕНИЯ
Учащимся предлагается новая информация, которую они должны отработать.
Задачи этой стадии:
- организация активной работы с информацией, увязать их уже с имеющимися знаниями
- активно отслеживать свое понимание (каждому)
Эта технология связана с текстом и письмом. Требования к тексту: 7-10 минут прочтения. Текст-это последовательность осмысленных высказываний, передающих информацию, объединенных общей темой, обладающих свойствами связности и целостности. Текст должен быть адаптирован, Читая текст, обсуждают в парах, взаимоопрос.
Мини-лекция.
Металлы – это элементы 1-3 групп главных подгрупп, а также всех побочных подгрупп периодической системы. Они хорошо проводят электрический ток. С чем это связано? Чтобы ответить на этот вопрос, необходимо установить особенности их строения. Что мы сегодня и сделаем.
Атомы металлов на внешнем энергетическом уровне имеют небольшое число электронов, поэтому они стремятся их отдать. Хорошо, если есть неметалл, который их примет. А если его нет, что тогда?
В куске металла, слитке или металлическом изделии атомы металла отдают внешние электроны и посылают их в этот кусок, слиток или изделие, превращаясь при этом в положительные ионы. «Оторвавшиеся» электроны перемещаются от одного иона к другому, временно снова соединяются с ними в атомы, снова отрываются. И этот процесс происходит непрерывно. В куске металла существуют то атомы, то ионы. Их так и называют атом-ионы. Здесь же присутствуют и свободные электроны, которые могут выступать в роли переносчиков электрических зарядов.
А схему образования металлической связи можно записать так: Ме0 – ne-←→ Mеn+ атомы ионы металла металла
, где n –
число внешних электронов, участвующих в образовании связи.
Наблюдается этот вид связи в металлах – простых веществах и сплавах. Таким образом, металлической
называется связь в металлах и сплавах между атом-ионами посредством обобществленных внешних электронов. Металлическая связь имеет некоторое сходство с ковалентной связью, так как основана на обобществлении внешних электронов. Однако при образовании ковалентной связи обобществляются внешние неспаренные электроны только двух соседних атомов, в то время как при образовании металлической связи в обобществлении этих электронов участвуют все атомы. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической, как правило, тверды, пластичны, электропроводны, теплопроводны и имеют металлический блеск.
Вопросы для обсуждения:
1.Для каких веществ характерна металлическая связь? 2. Какие частицы участвуют в ее образовании? 3.Как образуется металлическая связь? 4. Запишите в тетрадях схему образования металлической связи. 5.Какие свойства характерны для металлов? 6.В следующих предложениях вставьте пропущенные слова и выражения: «Связь в …………. и ……… между …………. посредством ……………………. электронов называют …………………… .(запишите в тетрадях)
3. СТАДИЯ РЕФЛЕКСИИ – ОСМЫСЛЕНИЕ
Учитель: Итак , ребята возвращаемся к нашей схеме. Какой тип химической связи характерен для данных веществ? Какие частицы участвуют в образовании этой связи? Этот процесс можно представить следующим образом:
(демонстрация слайдов 5-8 презентации)
Дайте определение металлической химической связи. (слайд 9) А сейчас я предлагаю закрепить изученный материал, работая по карточкам. Для организации работы воспользуйтесь алгоритмом. Время на работу 4-5 минут.
Карточка по видам химической связи
| Вариант I | Вариант II | Вариант III | Вариант IV | |
| 1 | CO2 | O2 | NaCl | Са |
| 2 | К2О | NO | К | Br2 |
| 3 | H2 | Na | SiН3 | Са2Р3 |
| 4 | Mg | КI | N2 | NH3 |
Алгоритм работы с карточкой
- Из предложенных в карточке формул веществ выбери формулу простого вещества металла.
- Запиши схему образования металлической химической связи для выбранного вещества.
- Обсуди полученные результаты с соседом по парте.
— Давайте проверим полученные результаты. Желающие работают у доски. (работа у доски)
— Проверим правильность выполнения задания. (демонстрация слайда 10)
— А как будет у алюминия? Попробуйте каждый самостоятельно в тетради, а …выполнит работу у доски.
— Проверим результат (демонстрация слайда 11)
— Особенности металлической связи мы рассмотрели. Ребята еще раз рассмотрите выданные вам образцы металлов и сплавов. Какими общими свойствами они обладают? (слайд12) Как вы думаете , чем обусловлены эти свойства? Правильно, металлической связью, а именно строением атома. То есть зная строение атома мы можем определить свойства вещества.
Молодцы. Я с вами согласна (или несогласна).
— Для подведения итога работы по теме, я предлагаю вам выполнить задание в тестовой форме, чтобы проверить как вы усвоили материал урока. (индивидуальная работа по карточкам с тестовым заданием)
Тест
1.Химическая связь –
а) взаимодействие между атомами б) взаимодействие между молекулами в) взаимодействие между электронами
2.Связь в металлах и сплавах между атом-ионами посредством обобществленных внешних электронов, называется
а) ковалентной б) ионной в) металлической
3.Положительно заряженный ион – это
а) катион б) анион в) электрон
4. Вещество, молекула которого образована посредством металлической связи:
а) H2 – водород б)Na – натрий в) H2S – сероводород.
5) Схема образования металлической химической связи:
а) Э0 – nе- → Эn+ б) Э0 + nе- → Эn- в) Э0 – nе-←→ Эn+
(проверка по слайду)
— Обменяйтесь своими работами и проверьте правильность выполнения заданий, используя ключ на экране.
— Кто смог ответить на все вопросы? Вы молодцы!
— На этом знакомство с металлической связью мы заканчиваем.
Запишите задание на дом. (слайд)
— И в завершении урока попробуйте проанализировать свою работу по желанию, начиная словами: Я научился- Я освоил- Я затрудняюсь- Я не смог- (слайд)
— Вы сегодня молодцы. Все смогли подняться еще на ступеньку выше в своих знаниях химии. Раскололи скорлупу ореха. Я благодарю вас за работу. До свидания.
Водородная связь
Элементы-неметаллы II периода (N, O, F) обладают высоким значением электроотрицательности. Это влияет на способность образования водородной связи между поляризованным Н+ одной молекулы и анионом N3-, O-2, F-. Водородная связь способна объединить две разные молекулы. К примеру, если взять две молекулы воды, то они соединяются между собой за счёт атомов Н и О.
Водородная химическая связь изображена …… пунктиром. Соединяясь между собою молекулы, играют и находят важную роль в живых организмах. С помощью водородной связи строится вторичная структура молекулы ДНК.