Ковалентная связь – определение, характеристика. Что такое ковалентная связь?
Сам термин «ковалентная связь» происходит от двух латинских слов: «со» – совместно и «vales» – имеющий силу, так как это связь происходящая за счет пары электронов, принадлежащей одновременно обоим
атомам(или говоря более простым языком, связь между атомами за счет пары электронов, являющихся общими для них). Образование ковалентной связи происходит исключительно среди атомов неметаллов, причем появляться она может как в атомах молекул, так и кристаллов.
Впервые ковалентная
химическая связьбыла обнаружена в далеком 1916 году американских химиком Дж. Льюисом и некоторое время существовала в виде гипотезы, идеи, лишь затем была подтверждена экспериментально. Что же выяснили химики по ее поводу? А то, что электроотрицательность неметаллов бывает довольно большой и при химическом взаимодействии двух атомов перенос электронов от одного к другому может быть невозможным, именно в этот момент и происходит объединение электронов обоих атомов, между ними возникает самая настоящая ковалентная связь атомов.
Конспект урока химии: Ковалентная полярная химическая связь, 8 класс
Конспект урока по химии для учащихся 8 класса на тему «Ковалентная полярная химическая связь»
Цель: организовать деятельность учащихся по изучению видов химической связи на примере ковалентной полярной химической связи Задачи: •Образовательные: изучить механизм образования ковалентной полярной химической связи; научиться составлять электронные формулы молекул веществ с ковалентной полярной связью; ввести понятие электроотрицательности и на основе этого объяснить природу ковалентной полярной связи. •Воспитывающие: создать условия для воспитания активности и самостоятельности; продолжение воспитания химически грамотной личности; воспитывать культуру научного труда; повышать интерес к проблемам современной науки. •Развивающие: развивать память и внимание учащихся, умение анализировать; формировать положительную мотивацию на изучение предмета химии; формировать умения определять вид ковалентной связи; учить применять знания в новой ситуации; развивать логическое мышление и умение самостоятельно делать выводы посредством обобщений. Оборудование и реактивы: периодическая система химических элементов Д. И. Менделеева; учебник: Габриелян О. С. Химия. 8 класс; рабочая тетрадь; интерактивная доска. Тип урока: комбинированный Форма организации учебной деятельности: — самостоятельная работа с текстом учебника, интерактивной доской. — фронтальная; Планируемые результаты Предметные
Знают: • механизм образования ковалентной полярной химической связи; • понятие электроотрицательность Умеют: • устанавливать причинно — следственные связи: состав вещества — вид химической связи — свойства; • устанавливать различия между понятиями «ковалентная полярная связь» и «ковалентная неполярная связь» • составлять схемы образования молекул соединений с ковалентной полярной химической связью; • писать и различать электронные и структурные формулы соединений Владеют: • навыками самостоятельно использовать материалы учебника и справочные таблицы, применять ранее полученные знания.
Метапредметные
Познавательные УУД: умения воспроизводить информацию по памяти; работать с различными источниками информации; сравнивать и анализировать информацию, делать выводы; давать определения понятиям; свободно и правильно излагать свои мысли в устной и письменной формах. Регулятивные УУД: умение определять степень успешности выполнения своей работы, исходя из имеющихся критериев; навыки самооценки и самоанализа. Коммуникативные УУД: умение отстаивать свою точку зрения, аргументируя её.
Личностные
• демонстрируют ответственное отношение к обучению и проявляют интерес к предлагаемой деятельности с учётом собственных интересов; • проявляют уважительное отношение к старшим (учителю) и одноклассникам и результатам их деятельности; • оценивают свою деятельность, определяя по заданным критериям ее успешность и способы ее корректировки;
Скачать Конспект урока по химии (8 класс) по теме: «Ковалентная полярная химическая связь»
Рекомендуем посмотреть:
Внеклассное мероприятие по химии для 8 класса Учебный лист по химии 8 класс Урок-путешествие по химии для 8 класса. Основания Обобщение раздела курса химии 8 класса «Основные классы неорганических веществ». Химический турнир
Похожие статьи:
Внеклассное мероприятие по химии для 8 класса
Конспект урока химии в 8 классе «Соли. Основания»
Внеклассное мероприятие по химии в 8 классе
Виды химических связей. Ковалентная и ионная связь
Как известно, атомы не могут существовать изолированно друг от друга. Они входят в состав либо простых, либо сложных веществ.
Только благородные или инэртные газы представляют собой одноатомные молекулы. В состав остальных веществ могут входить два атома, сотни и даже тысячи атомов. Сила, которые связывает эти молекулы, радикалы или кристаллы
называется
химическая связь
.
Таким образом, химическая связь
–
это взаимодействие, которое связывает отдельные атомы в более сложные системы (молекулы, радикалы, кристаллы и др.)
.
Существовать атомам изолированно друг от друга энергетически невыгодно
, поэтому при их взаимодействии друг с другом достигается более
устойчивое состояние
, то есть состояние с минимально возможным запасом энергии. Это состояние является основной причиной образования химической связи.
А основным условием образования химической связи является понижение полной энергии системы по сравнению с суммарной энергией изолированных атомов.
Например, при взаимодействии атомов А и Б образуется вещество АБ, энергия этого вещества будет меньше, чем суммарная энергия отдельных атомов А и Б.
Именно поэтому, образование химической связи всегда сопровождается выделением энергии
.
Природа сил химической связи
–
электростатическая
, так как обусловлена различными видами взаимодействия положительно заряженных ядер и отрицательно заряженных электронов.
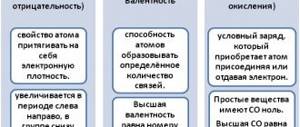
В образовании химической связи принимают участие
валентные электроны
, то есть те электроны, которые находятся на внешнем энергетическом уровне и наименее прочно связаны с ядром. При образовании химической связи каждый атом хочет завершить свой внешний энергетический уровень.
Внешний энергетический уровень считается завершённым, если на нём 8 электронов, исключение составляет первый период, где для завершения внешнего уровня необходимо 2 электрона.
Достичь этого состояния можно, если атомы при образовании химической связи объединят свои электроны с образованием общей электронной пары.
В зависимости от способа обобществления электронов различают
ковалентную
,
ионную
и
металлическую связь
.
Ковалентная связь
возникает между двумя атомами неметаллов с одинаковыми или разными значениями электроотрицательности.
Рассмотрим образование химической связи на примере молекулы водорода.
У каждого атома водорода на внешнем энергетическом уровне один электрон, до завершения внешнего уровня ему не хватает одного электрона. При сближении двух атомов водорода происходит частичное перекрывание электронных облаков неспаренных электронов с антипараллельными спинами. В зоне перекрывания облаков возникает область повышенной электронной плотности
.
Образование этой химической связи можно показать с помощью электронных формул
, где валентные электроны показаны в виде точек, или с помощью графических (структурных) формул, где пару электронов обозначают с помощью черточки.
Электронные формулы
Каждая такая чёрточка показывает ковалентную связь
. Образование химической связи также можно показать с помощью электронно-графических схем, в которых указываются орбитали внешнего энергетического уровня.
Графические (структурные) формулы
Так, при образовании молекулы водорода, химическая связь возникает в результате перекрывания двух эс-орбиталей.
Электронно-графические схемы
То есть, ковалентная связь
–
это химическая связь, которая возникает в результате обобществления электронов с образованием общих электронных пар
.
В молекуле водорода атомы связаны одной химической связью. Такую связь называют одинарной.
Причем, эта ковалентная связь образовалась путём перекрывания атомных орбиталей вдоль линии связи, поэтому такая связь называется сигма-связью
(
Рассмотрим пример образования химических связей в молекуле азота.
У атома азота на внешнем энергетическом уровне находится пять электронов, до завершения внешнего слоя ему не хватает трёх электронов. Поэтому в образовании химической связи принимают участие три неспаренных электрона от каждого атома. Схему образования молекулы азота также можно изобразить в виде электронной и графической формулы.
Электронная формула
Графическая (структурная) формула
Та пара электронов, которая образует ковалентную связь
, называется
связывающей
, а та
пара электронов, которая не участвует в образовании связи
, называется
несвязывающей
. Ещё называют неподелённой парой электронов, так как она принадлежит только одному атому. У каждого атома азота по одной такой паре электронов.
В молекуле азота между двумя атомами возникает тройная связь.
Причём, одна связь образовалась путём перекрывания пэ-электронных облаков вдоль линии связи, поэтому эта сигма-связь. Две другие связи образовались путём перекрывания вертикально направленных облаков пэ-электронов.
Это перекрывание идёт уже не вдоль линии, соединяющей центры атомов, а по обе стороны от неё. Таким образом, возникает две области перекрывания. Такая связь называется пи-связью
.
Сигма-связь
–
это ковалентная связь, которая возникает при перекрывании электронных облаков по обе стороны от линии, соединяющей ядра атомов
.
В образовании пи-связей принимают участие только пэ- и дэ-облака
.
Различают два вида ковалентной связи
:
полярную
и
неполярную
. Мы рассматривали примеры образования молекулы водорода и азота, эта ковалентная связь образована атомами одного и того же химического элемента, электронная пара симметрично располагалась между двумя атомами с одинаковой электроотрицательностью. Такая ковалентная связь называется
неполярной
.
Ковалентная полярная связь
возникает между атомами разных химических элементов, то есть с различной электроотрицательностью и общая электронная пара смещается к атому с большей электроотрицательностью.
Например, в образовании молекулы хлороводорода принимают участия атомы водорода и хлора, которые различаются по электротрицательности, причём общая электронная пара будет смещена к атому хлора, потому что он более электроотрицательный, чем водород.
При образовании молекулы происходит перекрывание эс-электронного облака атома водорода и пэ-электронного облака атома хлора. В результате смещения общей электронной пары к атому хлора на атоме хлора возникает частичный отрицательный заряд
, а на атоме водорода –
частичный положительный заряд
, который условно обозначается греческой буквой «
дэльта
», которая показывает, что этот заряд меньше единицы.
Значение заряда можно использовать как оценку полярности связи: чем больше частичные заряды на атомах, тем больше полярность связи
. Если взять молекулу фтороводорода и хлороводорода, то связь в молекуле фтороводорода будет более полярной, чем в молекуле хлороводорода, так как частичные заряды на атомах водорода и фтора плюс ноль целых сорок три сотых и минус ноль целых сорок три сотых, а на атомах водорода и хлора – плюс ноль целых восемнадцать сотых и минус ноль целых восемнадцать сотых.
Полярные молекулы можно представить в виде диполя
, в котором один полюс положительный, а второй – отрицательный. Например, связь в молекуле хлороводорода является
ковалентной полярной
, сама молекула тоже полярная.
В молекуле метана дело обстоит по-другому. Связи углерод-водородные являются полярными, а вот сама молекула является неполярной. Это объясняется тем, что молекула метана имеет вид тэтраэдра и полярность всех связей взаимно компенсируется.
Поэтому полярность молекулы зависит от полярности связей и от геометрии молекулы. Так, молекула воды имеет угловое строение, поэтому её молекула полярная и представляет собой диполь, а молекула угарного газа имеет линейное строение, потому сама молекула неполярна.
Существует два основных механизма образования ковалентной связи
– это
обменный
и
донорно-акцэпторный
.
Например, в образовании молекулы аммиака принимают участие три неспаренных электрона атома азота и один электрон от каждого атома водорода. У атома азота остаётся ещё одна неподелённая пара электронов. Каждая связь между азотом и водородом является полярной, поэтому вся молекула аммиака представляет собой диполь, она имеет форму пирамиды, на вершине которой расположен атом азота.
Поэтому механизм образования ковалентной связи за счёт обобществления неспаренных электронов двух взаимодействующих атомов называется обменным
.
Кроме того, образование ковалентной связи возможно и при взаимодействии атомов, один из которых имеет пару неподелённых электронов, а другой – свободную орбиталь. Например, при образовании молекулы АБ. При этом атом А предоставляет атому Б пару электронов, и эта пара электронов становится связывающей и возникает ковалентная связь.
Атом, который предоставляет электронную пару
, называется
донором
,
а атом, у которого есть свободная орбиталь
–
акцэптором
. Поэтому данный
механизм образования ковалентной связи называется донорно-акцэпторным
.
Донорно-акцэпторный механизм образования ковалентной связи
–
это такой механизм, при котором ковалентная связь возникает за счёт неподелённой пары электронов одного атома и свободной орбитали другого атома
.
Разберём данный механизм на примере образования иона аммония. Он образуется в результате взаимодействия аммиака с раствором кислоты.
В образовании химической связи в ионе аммония принимают участие неподелённая пара электронов азота и свободная орбиталь иона водорода.
Донорно-акцэпторный механизм позволяет объяснить существование иона гидроксония, эта частица образуется в результате гидратации иона водорода. При образовании иона гидроксония донором электронной пары является кислород, а акцэптором – ион водорода, который предоставляет свободную орбиталь.
Ковалентная связь имеет свои характеристики. Одной из важных характеристик ковалентной связи является её прочность
.
Мерой этой прочности является энергия, которую необходимо затратить, чтобы разорвать химическую связь
. Эту характеристику называют
энергией связи
.
Например, в молекуле водорода энергия связи равна 435 килоджоулей на моль, у молекулы фтора 159 килоджоулей на моль, а у молекулы азота 943 килоджоуля на моль. Соответственно, чем меньше энергия связи, тем менее прочной является ковалентная связь и тем больше реакционная способность вещества.
Ещё одной важной характеристикой ковалентной связи
является
длина связи
, то есть это
расстояние между ядрами атомов
.
С увеличение радиусов атомов длина связи
между ними увеличивается, а
прочность связи
– уменьшается
. Например, связь между атомами водорода более прочная, чем связь между атомами фтора, так длина её связи ноль целых семьдесят четыре тысячных нанометра, а связи между атомами фтора ноль целых сто сорок два тысячных нанометра.
Например, в органических соединениях длина одинарной связи ноль целых сто пятьдесят четыре нанометра, энергия связи 348 килоджоулей на моль, длина двойной связи ноль целых сто тридцать три нанометра, энергия связи 635 килоджоулей на моль, а длина тройной связи ноль целых сто двадцать нанометров, энергия этой связи 830 килоджоулей на моль. Таким образом, энергия двойной или тройной связи меньше удвоенной или утроенной энергии одинарной связи, поэтому одинарная связь
, которая является сигма-связью,
более прочная, чем пи-связь.
Ковалентная связь характеризуется насыщаемостью
. То есть число ковалентных связей, которое может образовывать атом, ограниченно. Число связей, которое может образовывать тот или иной атом определяется числом орбиталей, которые принимают участие в образовании химической связи.
Например, элементы второго периода, у которых на внешнем уровне только 4 орбитали (одна эс- и три пэ-орбитали) могут образовывать не более 4-х ковалентных связей. В образовании химических связей у других атомов принимают участие и дэ-орбитали внешнего и предвнешнего энергетического уровня.
Ковалентная связь характеризуется направленностью
, так как в образовании этой связи принимают участие электронные облака различной формы, и они расположены так в пространстве, чтобы их перекрывание было максимально.
Если происходит перекрывание эс-облаков
, то ковалентная связь может располагаться в любом направлении относительно центра атома
. Если же ковалентная связь образована за счёт перекрывания пэ-облаков
, то
область перекрывания располагается вдоль линии связи, и определена пространственной ориентацией пэ-облака
.
Рассмотрим ионную связь. Она возникает между атомами с различной электроотрицательностью.
Причём, в отличие от ковалентной полярной связи, разница в электроотрицательности атомов должна быть большой
, поэтому
общая электронная пара практически полностью смещена к атому с большей электроотрицательностью
. В результате этого образуются положительно и отрицательно заряженные ионы. Эти ионы удерживаются силами электростатического притяжения.
Таким образом, ионная связь
–
это химическая связь, которая осуществляется за счёт электростатического взаимодействия противоположно заряженных ионов
.
Как правило, ионная связь образуется между атомами типичных металлов и типичных неметаллов
. Например, хлорид натрия. Ион натрия образуется при отрыве от атома одного электрона, а ион хлора образуется при присоединении к атому хлора одного электрона. Между этими образовавшимися ионами возникает электростатическое притяжение, в результате чего образуется ионное соединение.
При образовании химической связи электроны от атома натрия перешли к атому хлора и образовались противоположно заряженные ионы, которые имеют завершенный внешний энергетический уровень.
Установлено, что электроны от атома металла не отрываются полностью, а лишь смещаются в сторону атома хлора, как в ковалентной связи
.
И это смещение тем больше, чем больше разность в электроотрицательности
. Типичный пример ионной связи – это фторид цэзия, где разница в электроотрицательности очень большая, но даже здесь электрон атома цезия не полностью переходит к атому фтора.
Поэтому мы можем говорить об ионной химической связи с определённой долей ковалентной.
Большинство бинарных соединений, которые содержат атомы металлов, являются ионными. Например, оксиды, галогениды, сульфиды, нитриды.
Ионная связь возникает также между простыми катионами и простыми анионами, а также между простыми катионами и сложными анионами. Поэтому к ионным соединениям относят соли и основания.